研究开发
公司共拥有103件专利,其中32件国际专利。
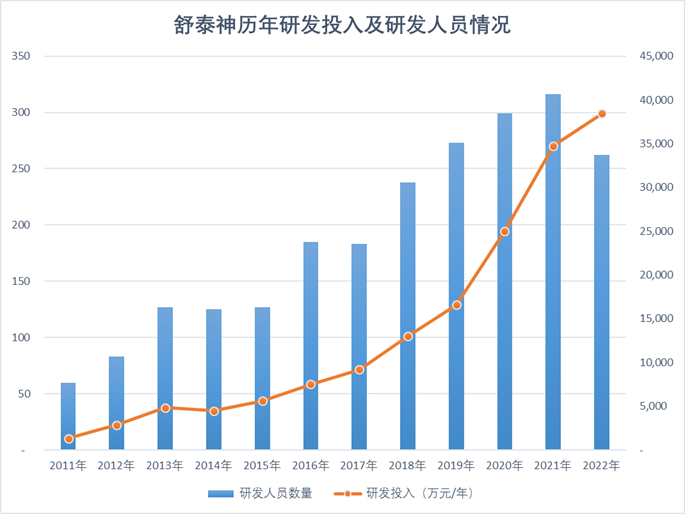
截止2022年12月31日,公司在职研发人员262人。
公司于2022年11月21日发布了《关于STSA-1002(ANCA相关性血管炎适应症)获得美国FDA同意开展临床试验的提示性公告》(公告编号:2022-55-09)。公司于2022年11月收到美国食品药品监督管理局(FDA)的通知邮件,同意STSA-1002皮下注射液关于ANCA相关性血管炎适应症开展临床试验。
公司于2022年09月29日发布了《关于注射用STSP-0601新增适应症取得临床试验通知书的公告》(公告编号:2022-44-01)。公司及全资子公司诺维康于2022年09月收到了国家药品监督管理局签发的注射用STSP-0601新增适应症的《药物临床试验批准通知书》(通知书编号:2022LP01612),同意本品开展“不伴抑制物的血友病A或B患者出血按需治疗”的临床试验。
公司于2022年09月06日发布了《关于注射用STSP-0601纳入突破性治疗品种的公告》(公告编号:2022-37-01)。根据国家药品监督管理局药品审评中心发布的公示信息,舒泰神申请突破性治疗品种的注射用STSP-0601项目用于伴抑制物的血友病A或B患者出血按需治疗近日完成公示,已被纳入突破性治疗品种名单。
公司于2022年08月11日发布了《关于STSA-1002注射液和STSA-1005注射液联用取得临床试验通知书的公告》(公告编号:2022-31-01)。
公司于2022年02月25日发布了《关于BDB-001注射液(ANCA相关性血管炎适应症)完成首例受试者给药的公告》(公告编号:2022-09-01)。公司及全资子公司德丰瑞于2021年08月收到中国国家药品监督管理局签发的BDB-001注射液用于治疗ANCA相关性血管炎(AAV)适应症的《药物临床试验批准通知书》,同意本品开展用于抗中性粒细胞胞质抗体相关性血管炎(AAV)患者的临床试验。
公司于2022年01月13日发布了《关于STSA-1002注射液I期临床试验(国内)完成首例受试者给药的公告》(公告编号:2022-02-01)。公司收到中国国家药品监督管理局签发的STSA-1002注射液用于治疗重型COVID-19的《药物临床试验批准通知书》,同意本品开展临床试验。